病理性骨折与骨肉瘤患者预后的相关性及手术方式的选择
2023-03-21 我要说
骨肉瘤是儿童和青少年最常见的原发恶性骨肿瘤,其预后差。目前骨肉瘤患者5年生存率约为60-70%,转移患者则更低。多种因素已被证实影响骨肉瘤患者预后。病理性骨折(pathologic fractures,PFs)是骨肉瘤患者常见并发症之一(图1),但PFs对骨肉瘤患者预后的影响以及针对该类患者治疗方式的选择一直以来存在争议。因此,有必要针对这一问题进行文献回顾和讨论。

图1. 右肱骨近端骨肉瘤的病理性骨折(来自Xie L,J Surg Oncol.2012.)
1、骨肉瘤患者发生病理性骨折的原因有哪些?
PFs在骨肉瘤患者中发生率约为5%-10%,尤其好发于高级别原发性骨肉瘤患者,肱骨和股骨多见(图2)。骨肉瘤患者发生PFs的原因包括:组织分化程度、细胞密度、骨皮质破坏、骨基质丢失、活检或化疗后肿瘤坏死致骨机械支撑强度减弱等。

图2.骨肉瘤病理性骨折发生部位(来自Bramer JA,Eur J Cancer.2007.)
2、病理性骨折对骨肉瘤患者的预后有影响吗?
以往认为,PFs对骨肉瘤患者的疾病进程有不利影响。主要理论依据为PFs通过形成血肿导致肿瘤细胞扩散并污染相邻软组织、关节或进入血管系统,促进肿瘤局部复发或远处转移。多项研究探讨了PFs和骨肉瘤预后之间的关系。
Coley, Lee等人报道, PFs骨肉瘤患者的总生存率降低,并将其归因于肿瘤扩散。然而,Haynes L等其他研究者报道,PFs未增加骨肉瘤患者局部复发和远处转移的风险,患者的总生存率也未受到PFs的影响。
因此,关于PFs和骨肉瘤患者预后关系的研究结果并不一致(Table 1),各研究结果的差异原因值得深思。那么,PFs对骨肉瘤患者预后的确切影响是什么? 针对这类患者的治疗策略是否需要调整? 接下来,让我们一起走进三篇关于PFs和骨肉瘤患者预后的代表性文献。
SEAN P等人2002年报道了一项多中心回顾性研究,研究纳入了52例PFs和55例NPFs患者。单因素分析显示,PFs患者5年无病生存率降低、局部复发率升高。并且多因素分析显示,PFs是骨肉瘤患者局部复发的显著独立危险因素。但Xie L、Haynes L等人的研究显示,PFs对患者生存率和局部复发率均无明显影响。
对比三项研究可发现,在SEAN P等人的研究中,只有63%的患者在术前接受了化疗,而Xie L和Haynes L等人的研究中,所有患者术前均进行新辅助化疗(Table 2)。此外,Xie L和Haynes L的研究纳入患者的平均年龄均在15岁以下, 并且Xie L的研究中,骨折组儿童患者比例显著高于非骨折组。这提示我们,年龄和新辅助化疗是各项研究结果差异的可能原因。

以往关于病理性骨折与骨肉瘤患者预后的研究很少有涉及年龄因素的亚组分析。那么,PFs对骨肉瘤患者预后的影响与年龄、新辅助化疗及化疗敏感性的相关性是否真实存在呢?接下来分享的两篇来自Schlegel M和Kelley LM等人的文章对进一步理解PFs和患者预后之间的关系可能有很大的帮助和启发。
Schlegel M和Kelley LM等人2018年在Oncology发表了一篇关于PFs和骨肉瘤患者预后的文章,该文章首次对儿童和成人骨肉瘤患者进行分层分析,比较了PFs分别对儿童和成人骨肉瘤患者预后的影响,作者回顾了单中心2000年-2011年诊断为骨肉瘤(OS)和尤文肉瘤(ES)患者,对患者生存率和局部复发进行了整体分析和年龄亚组分析。
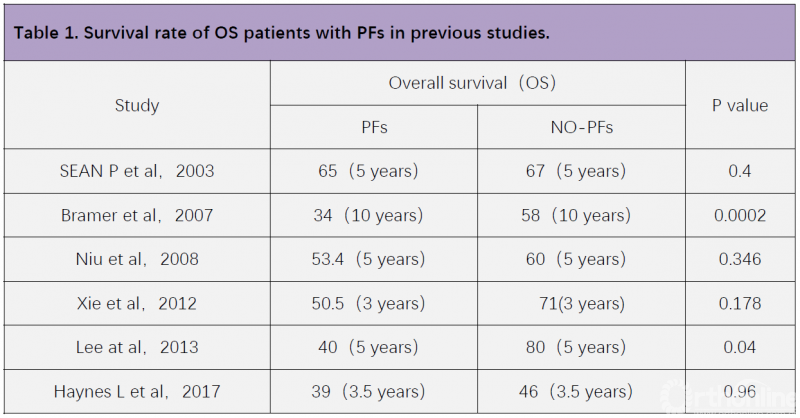
骨肉瘤患者的整体分析结果显示, PFs患者5年生存率显著降低(P=0.024),局部复发率明显增加(P=0.042)。对成人组患者的分析结果与整体患者分析结果一致,并且成人组PFs对5年生存率和复发率影响的显著性较整体分析明显提高(5年生存率,P=0.004;5年局部复发率,P=0.024)。但儿童组分析显示,PFs对5年局部复发率和生存率均无明显影响(5年生存率,P=0.806;5年局部复发率, P=0.573)。尤文肉瘤患者整体分析和亚组分析结果一致,PFs对ES患者的5年生存率(P=0.436)和局部复发率(P=0.320)均无显著影响(图3)。
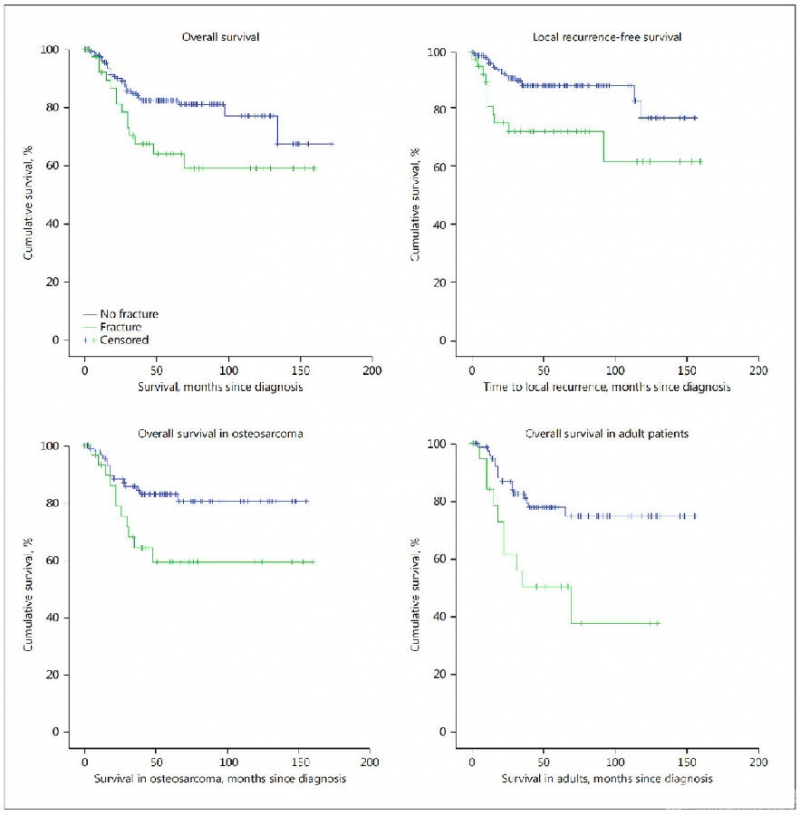
图3. 生存分析(来自Schlegel M,Oncology.2018.)
该文章结果提示,成人组骨肉瘤患者5年生存率和局部复发都受到PFs的影响,但PFs均不影响骨肉瘤儿童组患者和各年龄尤文肉瘤患者的5年生存率和局部复发率。为何PFs影响骨肉瘤成人患者预后,而非骨肉瘤儿童,对尤文肉瘤患者预后普遍影响较小呢?我们认为,可能原因有:
1) 根据以往研究,与骨肉瘤患者相比,尤文肉瘤患者对化疗更敏感。这篇研究也再次证明这点,47.6%的骨肉瘤对化疗反应良好、尤文肉瘤高达73.6%(P<0.05)。
2) 骨肉瘤儿童患者比成人患者对化疗更加敏感?在这篇研究中,骨肉瘤成人组中46.4%患者对新辅助化疗反应良好,骨肉瘤儿童组患者为65.4%(P<0.05);此外,儿童骨肉瘤患者的化疗敏感性(65.4%)和尤文肉瘤患者化疗敏感性(73.6%)相近。
Schlegel M和Kelley LM等人2018年的这篇文章提醒我们,PFs对OS儿童和成人预后可能有着不同的影响,可能是由化疗敏感性差异引起,这也突出了新辅助化疗对PFs患者尤为重要。当然,也可能存在其他原因,例如儿童和成人患者的血肿微环境、免疫反应等差异。
为进一步明确上述发现,Schlegel M和Kelley LM等人扩大样本量,回顾性分析了2847例1980年-2010年间治疗的原发性高级别四肢骨肉瘤患者,并于2020年发表在著名杂志American Society of Clinical Oncology。这是迄今为止评估PFs预后价值规模最大的骨肉瘤患者队列研究。该研究评估了PFs与骨肉瘤换预后之间的相关性,除对所有患者进行生存分析外,还对成人和儿童组骨肉瘤患者进行亚组分析。整体分析显示,PFs患者总生存率和无事件生存率显著低于无PFs患者, PFs在整个队列中具有显著的阴性预后价值(5年OAS,P=0.007;5年EFS,P=0.026)(图4)。
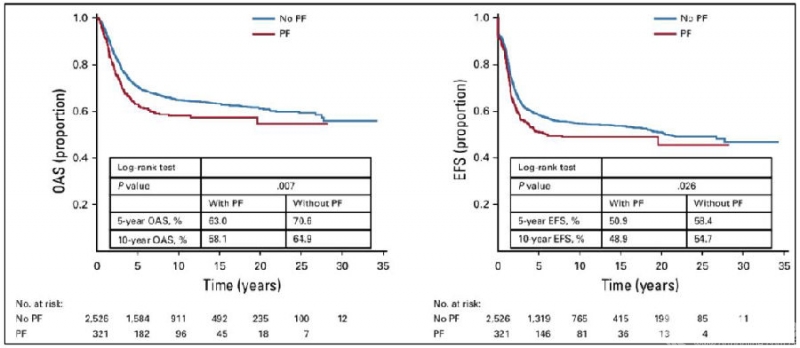
图4. 整个队列骨肉瘤患者的生存分析(来自Kelley LM et al, J Clin Oncol. 2020.)
成人组分析结果和整体分析结果仍一致,并且PFs对成人组骨肉瘤患者预后影响的显著性更高(5年OAS,P<0.001;5年EFS,P<0.001)(图5)。但儿童组分析结果显示,PFs对儿童骨肉瘤患者的预后无明显影响(5年OAS,P=0.649;5年EFS,P=0.604)(图6)。在局部复发率方面,整体分析显示,PFs患者的局部复发率显著增高(P=0.065),在成人组分析也得到一致结果(P=0.007),但儿童组,PFs并未增加局部复发率(P=0.689)(Table 3)。
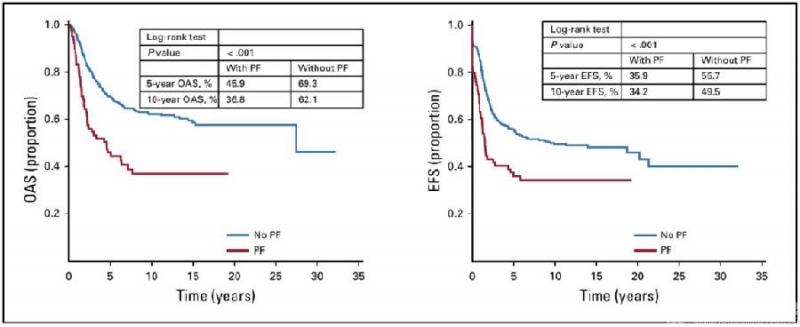
图5. 成人组骨肉瘤患者的生存分析(来自Kelley LM et al,J Clin Oncol.2020.)
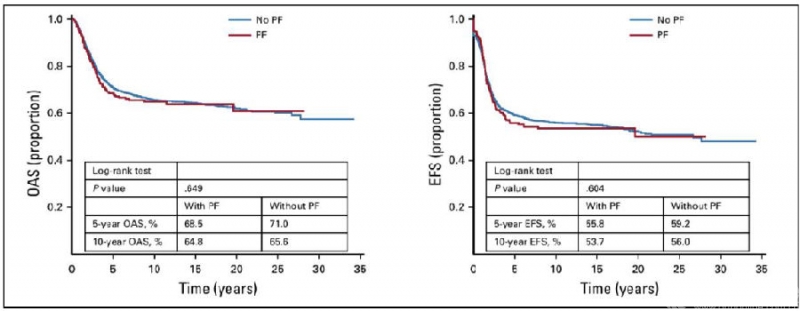
图6. 儿童组骨肉瘤患者的生存分析(来自Kelley LM et al,J Clin Oncol.2020.)
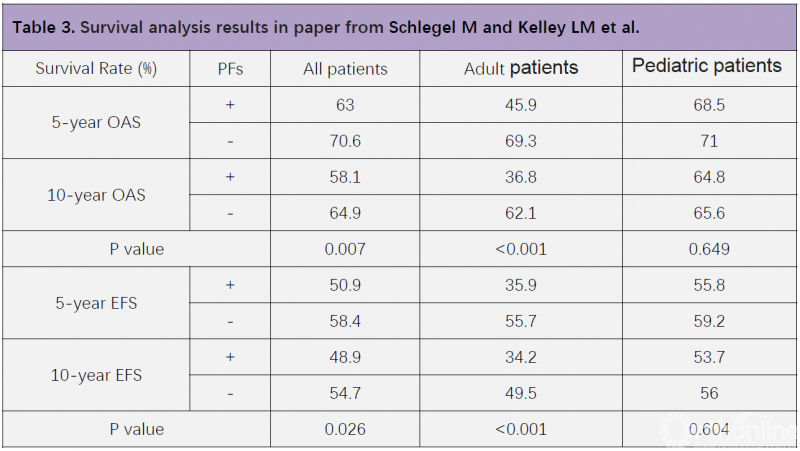
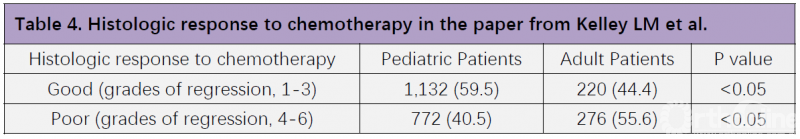
Schlegel M和Kelley LM等人的这篇研究再次说明,PFs主要影响成人骨肉瘤患者的预后,而非儿童患者。那么,PFs对骨肉瘤儿童和成人患者预后产生不同影响的原因到底是什么呢?从这篇研究中我们可发现,59.5%的骨肉瘤儿童患者对新辅助化疗反应良好、达到1-3级,但骨肉瘤成人患者中,对新辅助化疗反应良好的仅占44.4%(Table 4)。因此,化疗敏感性差异可能是导致PFs对骨肉瘤儿童和成人患者产生不同影响的原因之一。
综合各研究,PFs对骨肉瘤患者预后和局部复发的影响主要集中在对新辅助化疗不敏感的OS成人患者中,PFs对OS儿童患者的预后无显著影响。OS成人和儿童患者的化疗敏感性差异可能是导致该结果的原因之一。然而,化疗反应是否为PFs影响OS患者预后的相关因素仍有待研究进一步证实,针对化疗反应的亚组分析对于解决这一问题是有必要的。
3、伴发病理性骨折的骨肉瘤患者可以安全地进行保肢手术吗?
考虑到PFs有导致疾病进展的风险,PFs过去被认为是骨肉瘤患者保肢治疗的禁忌症,并与骨肉瘤患者局部复发和不良预后相关,其主要原因为:
1)局部血肿形成,导致肿瘤细胞扩散至周围组织和邻近关节;
2)微循环损伤可能促进转移。
但是,近年来,随着新辅助化疗的发展,病理性骨折似乎不再认为是保肢手术的禁忌证。几项研究比较了PFs骨肉瘤患者保肢手术和截肢手术的局部和全身结果,显示了保肢治疗的安全性和有效性。
SEAN P等人2002年发表了首篇多中心回顾性研究,结果显示,接受保肢手术和截肢手术的PFs患者的5年生存率无显著差异(图7)。随后,Zhu J等、Malagelada F等、Haynes L等的研究以及多项Meta分析也得出一致的结果。
尽管也有研究报道,保肢手术的局部复发率高于截肢手术,但两种手术方式在生存率或转移性扩散方面无显著差异。目前关于骨骨肉瘤PFs的治疗方法的对比研究较少,多中心和前瞻性研究是必要的,将有助于这一患者群体的治疗。
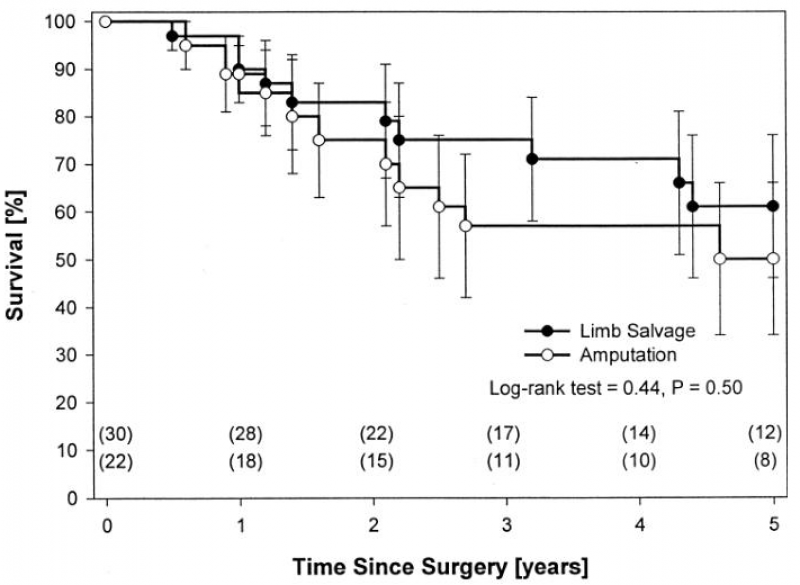
图7. 保肢和截肢手术骨肉瘤患者的生存分析(来自SEAN P et al,J Clin Oncol.2002.)
第二节内容中提到,PFs对骨肉瘤儿童和成人患者预后产生不同影响,化疗敏感性可能是这一差异的主要原因,这突出了新辅助化疗对于该类患者的重要性。也提示临床医生:在治疗选择决策时,化疗反应是预测整体生存和局部控制的指标之一。
此外,对发生PFs的骨肉瘤患者,分层治疗可能是必要的,尤其对于成人骨肉瘤患者,如何优化化疗方案,提高化疗敏感性是减少PFs对其预后影响的有效措施。但是,对化疗耐药的成人患者,在选择保肢手术时需更加慎重。
局部复发和预后与包肢手术中肿瘤切缘之间存在相关性。对发生病理性骨折的骨肉瘤患者应进行积极的新辅助化疗,并尽可能通过获得安全的手术边缘实现局部控制和肢体功能的保留。同时,优化化疗方案、提高化疗敏感性是消除PFs对骨肉瘤患者预后影响的有前景措施。
有理由认为,保肢手术是原发性骨肉瘤患者病理性骨折的首选治疗方法。在合理的化疗方案和严格的病例选择条件下,发生PFs的骨肉瘤患者可以安全地接受保肢手术治疗。同时,PFs骨肉瘤患者在选择治疗方案时需要考虑以下因素:
1) 患者年龄,肿瘤组织对新辅助化疗的敏感程度,化疗后是否能获得良好的外科边界;
2) 骨折粉碎程度;
3) 骨折是否累及血管神经结构;
4) 非包裹性血肿,肿瘤或血肿对周围组织和邻近关节的侵袭程度;
5) 术中能否获得安全的手术边缘;
6) 有无多发转移扩散;
7) 单发或多发骨折,能否一期全部切除并重建肢体功能;
8) 周全的围手术期计划等;
9) 患者及家属意愿。
参考文献:
[1] Huvos AG et al. Telangiectatic osteogenic sarcoma: a clinicopathologic study of 124 patients. Cancer. 1982.
[2] Carsi B. Primary osteosarcoma in adults older than 40 years. Clin Orthop Relat Res. 2002.
[3] SEAN P. Pathologic fracture in osteosarcoma. J Bone Joint Surg Am. 2002.
[4] Bramer JA et al. Do pathological fractures influence survival and local recurrence rate in bony sarcomas? Eur J Cancer. 2007.
[5] Xie L. Pathologic Fracture Does Not Influence Local Recurrence and Survival in High-Grade Extremity Osteosarcoma With Adequate Surgical Margins. J Surg Oncol. 2012
[6] Zuo D, Zheng L, Sun W, Hua Y, Cai Z. Pathologic fracture does not influence prognosis in stage IIB osteosarcoma: a case-control study. World J Surg Oncol. 2013 Jun 24;11:148. doi: 10.1186/1477-7819-11-148. PMID: 23799947; PMCID: PMC3711896.
[7] Salunke AA, Chen Y, Tan JH, Chen X, Khin LW, Puhaindran ME. Does a pathological fracture affect the prognosis in patients with osteosarcoma of the extremities? : a systematic review and meta-analysis. Bone Joint J. 2014 Oct;96-B(10):1396-403. doi: 10.1302/0301-620X.96B10.34370. PMID: 25274928.
[8] Malagelada F et al. Pathological fracture in osteosarcoma: is it always an indication for amputation? Ortop Traumatol Rehabil. 2014.
[9] Deng ZP, Ding Y, Puri A, Wang EH, Gulia A, Durban C, Niu XH. The Surgical Treatment and Outcome of Nonmetastatic Extremity Osteosarcoma with Pathological Fractures. Chin Med J (Engl). 2015 Oct 5;128(19):2605-8. doi: 10.4103/0366-6999.166025. PMID: 26415798; PMCID: PMC4736862.
[10] Chung LH, Wu PK, Chen CF, Weng HK, Chen TH, Chen WM. Pathological fractures in predicting clinical outcomes for patients with osteosarcoma. BMC Musculoskelet Disord. 2016 Dec 28;17(1):503. doi: 10.1186/s12891-016-1351-x. PMID: 28031047; PMCID: PMC5192576.
[11] Salunke AA, Shah J, Gupta N, Pandit J. Pathologic fracture in osteosarcoma: Association with poorer overall survival. Eur J Surg Oncol. 2016 Jun;42(6):889-90. doi: 10.1016/j.ejso.2016.02.255. Epub 2016 Mar 14. PMID: 27012998.
[12] Haynes L. Pathologic fracture in childhood and adolescent osteosarcoma: A single-institution experience. Pediatr Blood Cancer. 2017
[13] Zhou Y, Lu Q, Xu J, Yan R, Zhu J, Xu J, Jiang X, Li J, Wu F. The effect of pathological fractures on the prognosis of patients with osteosarcoma: a meta-analysis of 14 studies. Oncotarget. 2017 Aug 21;8(42):73037-73049. doi: 10.18632/oncotarget.20375. PMID: 29069847; PMCID: PMC5641190.
[14] Zhu J, He T, Wei Z, Wang Y. Retrospective analysis of the effect of treatment of osteosarcoma complicated by pathological fracture by neoadjuvant chemotherapy combined with limb salvage surgery. J BUON. 2018.
[15] Schlegel M. Impact of Pathological Fractures on the Prognosis of Primary Malignant Bone Sarcoma in Children and Adults: A Single-Center Retrospective Study of 205 Patients. Oncology. 2018.
[16] Zhu J, He T, Wei Z, Wang Y. Retrospective analysis of the effect of treatment of osteosarcoma complicated by pathological fracture by neoadjuvant chemotherapy combined with limb salvage surgery. J BUON. 2018 Nov-Dec;23(6):1809-1815. PMID: 30610807.
[17] Lozano Calderón SA, Garbutt C, Kim J, Lietz CE, Chen YL, Bernstein K, Chebib I, Nielsen GP, Deshpande V, Rubio R, Wang YE, Quackenbush J, Delaney T, Raskin K, Schwab J, Cote G, Spentzos D. Clinical and Molecular Analysis of Pathologic Fracture-associated Osteosarcoma: MicroRNA profile Is Different and Correlates with Prognosis. Clin Orthop Relat Res. 2019 Sep;477(9):2114-2126. doi: 10.1097/CORR.0000000000000867. PMID: 31389890; PMCID: PMC7000091.
[18] Kelley LM et al. Pathological Fracture and Prognosis of High-Grade Osteosarcoma of the Extremities: An Analysis of 2,847 Consecutive Cooperative Osteosarcoma Study Group (COSS) Patients. J Clin Oncol. 2020.


 京公网安备11010502051256号
京公网安备11010502051256号